Исследователи лаборатории структурной химии ФИЦ ПХФ и МХ РАН (Черноголовка, Моск. обл.) под руководством Т.А. Баженовой и В.Е. Баулина синтезировали и изучили четыре новых комплекса меди(II) с подандами, содержащими терминальные 8-оксихинолильные группы. Целью работы был поиск перспективных металлокомплексных соединений с противоопухолевой активностью, альтернативных платиновым препаратам. Исследование проводилось с использованием дифрактометра Tongda TD-5000. Этот прибор предназначен для монокристальной рентгеновской дифрактометрии – метода определения точной атомной структуры кристаллических веществ. Прибор генерирует рентгеновское излучение, которое, рассеиваясь на атомах кристаллической решетки, образует дифракционную картину. Анализ этой картины позволяет установить трехмерное расположение атомов, межатомные расстояния и углы в молекуле. Дифрактометры серии TD-5000 являются ключевыми инструментами в химии, материаловедении и фармацевтике для расшифровки строения веществ.
Ключевые исследования
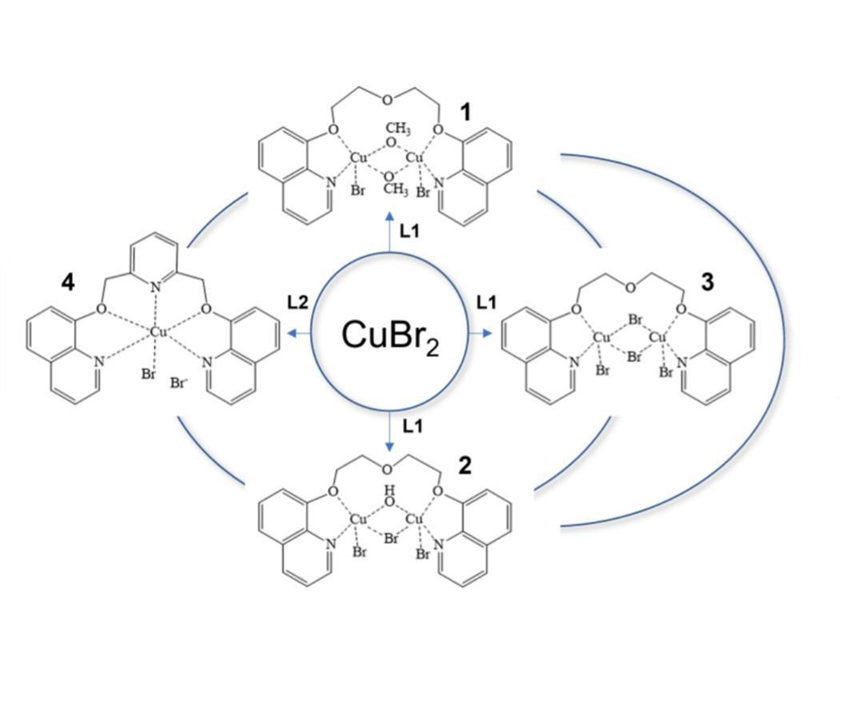
Синтез лигандов и комплексов: Лиганды L¹ (1,5-бис(8-оксихинолил)-3-оксапентан), L² (2,6-бис((8-оксихинолил)метил)пиридин) и L³ (1,8-бис(8-оксихинолил)-3,6-диоксаоктан) синтезированы одностадийной реакцией натриевой соли 8-гидроксихинолина с соответствующими дитозилатами гликолей. Реакцией CuBr₂ с L¹ и L² в различных растворителях (метанол, этанол, ацетонитрил) получены комплексы:
- [Cu₂L¹Br₂(μ-OCH₃)₂] (1) (биядерный, метоксильные мостики)
- [Cu₂L¹Br₂(μ-OH)(μ-Br)] (2) (биядерный, гидроксо- и бромидный мостики)
- [Cu₂L¹Br₂(μ-Br)₂]·CH₃CN (3) (биядерный, бромидные мостики)
- [CuL²Br]Br (4) (моноядерный, ионный).
Структурные исследования: Методом рентгеноструктурного анализа установлено, что комплексы 1-3 имеют биядерную структуру, где атомы меди связаны различными μ₂-мостиками (OCH₃, OH/Br, Br). Комплекс 4 моноядерный. Во всех биядерных комплексах атомы меди координированы азотом хинолильных фрагментов лиганда, а кислородные атомы полиэфирной цепи L¹ не участвуют в связывании меди, в отличие от комплексов щелочных металлов. Структурные различия обусловлены гибкостью лиганда L¹ и условиями синтеза. Комплекс меди с L³ не удалось получить в кристаллической форме.
Цитотоксическая активность (in vitro): Исследована на 4 линиях раковых клеток (A549 – аденокарцинома легкого, HeLa – рак шейки матки, SH-SY5Y – нейробластома, MCF-7 – аденокарцинома молочной железы) и нормальных клетках Hek-293 (почки эмбриона человека) с помощью МТТ-теста.
- Все комплексы меди (1-4) показали значимо более высокую цитотоксичность по сравнению со свободными лигандами (L¹, L², L³), у которых IC₅₀ > 100 мкМ для всех линий.
- Наибольшую активность против линии A549 проявили комплексы 3 (IC₅₀ = 21.43 ± 0.20 мкМ) и 4 (IC₅₀ = 30.67 ± 2.23 мкМ).
- Комплексы демонстрировали селективность в отношении опухолевых клеток по сравнению с нормальными Hek-293. Для комплекса 3 индекс селективности (отношение IC₅₀ Hek-293 / IC₅₀ A549) составил 2.
Механизмы действия
- Индукция апоптоза: Анализ с аннексином V и SYTOX Blue показал, что комплексы 1 и 4 (при концентрации IC₅₀, 24 ч) достоверно увеличивают долю апоптотической популяции клеток A549 более чем в 2 раза по сравнению с контролем. Комплексы 2 и 3 также проявляли проапоптотическую активность, но менее выраженно. Некроз не индуцировался.
- Ингибирование гликолиза: С помощью анализатора Seahorse XF96 установлено, что все комплексы 1-4 (в отличие от исходных лигандов) существенно подавляют параметры гликолитической функции (базальный гликолиз, гликолитическую емкость, гликолитический резерв) в клетках A549. Эффект был дозозависимым. Это указывает на то, что аномальный гликолиз — одна из первичных мишеней действия комплексов.
- Клеточное поглощение и локализация: Конфокальная микроскопия подтвердила, что все комплексы проникают в клетки A549 и локализуются в перинуклеарном пространстве, не попадая в ядра.
Выводы: Новые комплексы меди(II) на основе подандов с терминальными 8-оксихинолильными группами продемонстрировали перспективную противоопухолевую активность in vitro, превосходящую активность свободных лигандов. Их цитотоксическое действие связано со способностью проникать в клетки, ингибировать ключевой для опухолевых клеток процесс гликолиза и индуцировать апоптоз. Наиболее активный комплекс 3 показал селективность в отношении раковых клеток. Полученные результаты формируют основу для дальнейших исследований этих соединений как потенциальных противоопухолевых агентов.
Авторы оригинальной статьи: Тамара А. Баженова, Геннадий В. Шилов, Денис В. Корчагин, Галина С. Цебрикова, Юлия Р. Александрова, Дмитрий В. Баулин, Наталья С. Николаева, Мария А. Лапшина, Маргарита Е. Неганова, Владимир Е. Баулин.
Данный материал является краткой версией. Полный текст доступен на сайте источника




.png)